背景
热休克蛋白90(Hsp90)是一种众所周知的依赖ATP的蛋白,可实现细胞在体内的平衡,Hsp90蛋白在癌细胞的生长和增殖中起着重要作用。此外,激酶水平还与Hsp90分子伴侣周期高度相关,这使Hsp90成为了抗癌治疗的靶标。但是,在Hsp90分子伴侣周期中,Hsp90抑制剂会与ATP口袋结合,最终阻止了ATP的水解,不可避免地损害了所有Hsp90。因此,现阶段研究表明单纯的抑制Hsp90或直接靶向Hsp90 ATPase结合位点可能不是实现癌症治疗的最佳选择。因此,我们必须找到新的策略或找到以前未知的结合位点从而实现抗癌效果。伴侣蛋白Cdc37负责将激酶募集到Hsp90,是Hsp90伴侣蛋白系统的一种靶向激酶的特定亚基,在结合开放状态的Hsp90之前,Cdc37可选择性地识别并结合未折叠的激酶蛋白。迄今为止,已经报道了Hsp90-Cdc37的两个晶体结构,但是精确的识别相互作用和潜在的小分子结合位点我们仍然不清楚。因此寻找与Hsp90-Cdc37的关键残基相互作用的特定小分子具有重要的意义。通过识别关键残基并选择性破坏Hsp90和Cdc37之间的相互作用可以精确阻断激酶客户的折叠,从而达到抗癌治疗的作用。到目前为止,还没有小分子与Hsp90或Cdc37特异性结合的报道,Science Advances杂志在线发表了中国药科大学尤启冬教授和上海交通大学张健教授课题组合作研发的Hsp90-Cdc37蛋白-蛋白相互作用的小分子抑制剂DDO-5936,该工作首次阐明Hsp90-Cdc37及特异性的小分子抑制剂的结构。通过对Hsp90-Cdc37结合界面有重大贡献的残基进行分子动力学(MD)模拟,并通过诱变进一步鉴定数据。结果表明,Hsp90上的E47和Q133与Cdc37上的R167之间相互作用,是Hsp90-Cdc37 PPI结合的决定因素。总而言之,这些结果表明DDO-5936的发现可能已经确定了Hsp90 N末端先前未知的结合位点,从而破坏了它与Cdc37的相互作用,通过对Hsp90及其伴侣分子周期的调控和对Hsp90-Cdc37的功能深刻的了解,Hsp90-Cdc37蛋白-蛋白相互作用可能成为一种新型且有效的癌症治疗靶标。
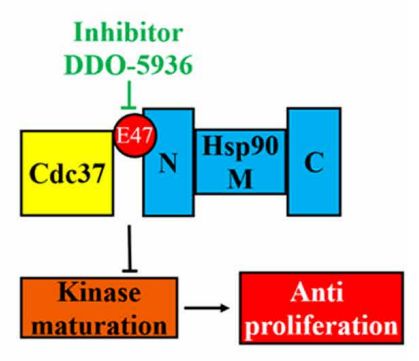
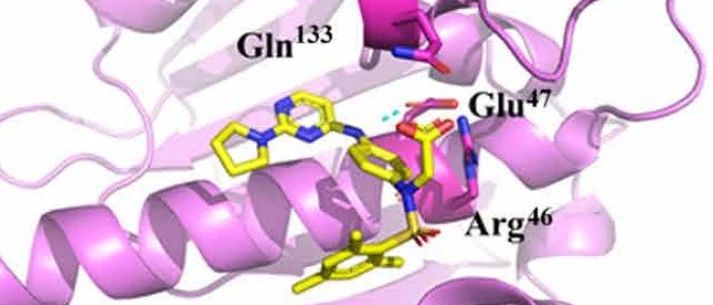
图1.DDO-5936与Hsp90-Cdc37的相互作用机制
图片来自ScienceAdvances
分子动力学模拟蛋白-蛋白相互作用
本研究首先通过长程的分子动力学模拟蛋白-蛋白相互作用过程中的动态变化,Hsp90-Cdc37复合物的结构均从蛋白质数据库(PDB)获得。从PDB获得了两种已知的复合物(PDB ID:1US7和2K5B),用于进一步分析。首先去除结晶水分子并使用TIP3P水分子将复合物溶剂化,将抗衡离子添加到了溶剂中。在执行MD之前,将整个系统分两步进行最小化。然后,将整个系统从0加热到300 K,最后,在恒定压力下使用50 ns的生产动态进行进一步分析,并以20 ps的间隔保存。接着计算Hsp90-Cdc37动态结合过程中的结合自由能并进一步分析单个氨基酸结合位点对其影响,得到了动态结合面中不同的氨基酸残基对结合贡献的大小。并在此结果的基础上,并通过对关键结合位点上突变蛋白的测试,验证了结合面上起到关键作用的氨基酸残基,并首次证明了Hsp90蛋白中的Glu47、Gln133与Cdc37蛋白中的Arg167形成的氢键作用网是Hsp90-Cdc37蛋白-蛋白相互作用的关键,其中任一氨基酸的突变会造成全部亲和力的丧失。因此,研究此关键相互作用所在的结合区域成为了抑制剂设计的重要基础。
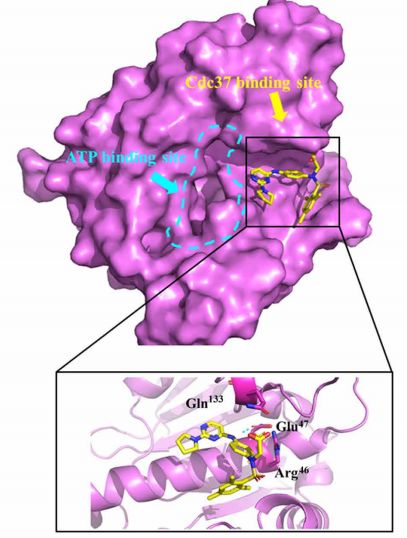
图2. DDO-5936与Hsp90-Cdc37 PPI界面上的关键残基结合
图片来自ScienceAdvances
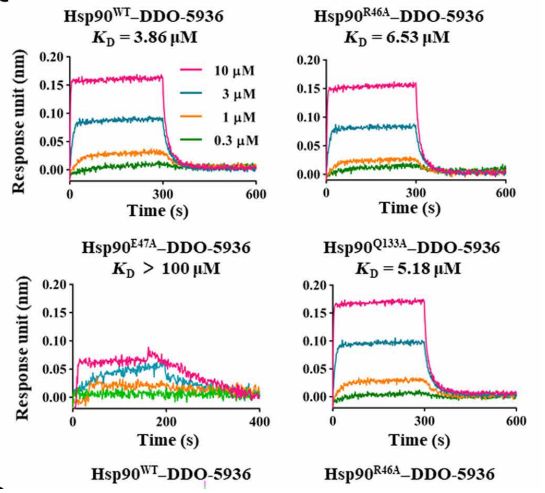
图3. 关键氨基酸的突变对亲和力影响
图片来自ScienceAdvance
在深入地研究了Hsp90-Cdc37蛋白-蛋白相互作用表面的识别机制后,尤启冬教授等人基于前期实验结果,进一步开展了对抑制剂设计策略的筛选。从1500,000化合物商业库中筛选包含正电或碱性基团的化合物,过滤得到含有120,537个化合物的靶向库,然后通过分子对接特异性筛选可以靶向于关键相互作用网络的小分子,随后筛选其结合模式并计算其结合自由能,结合结构多样性,根据Hsp90-Cdc37复合物的晶体结构(PDB ID:2K5B和1US7),我们使用Hsp90上的关键残基(包括E47和Q133)来预测潜在的结合位点。然后,通过级联对接进行配体对接,包括标准精度对接,超精度对接和MM / GBSA评分。最终选择33个化合物进行测试,最后通过体外高通量筛选得到了先导化合物compound 11(21.1μM)。通过进一步的结构优化,得到了亲和力更高、结合模式明确、细胞内有效的Hsp90-Cdc37蛋白-蛋白相互作用调控剂DDO-5936,其体外亲和力达到低微摩尔级别。整个筛选流程如下:
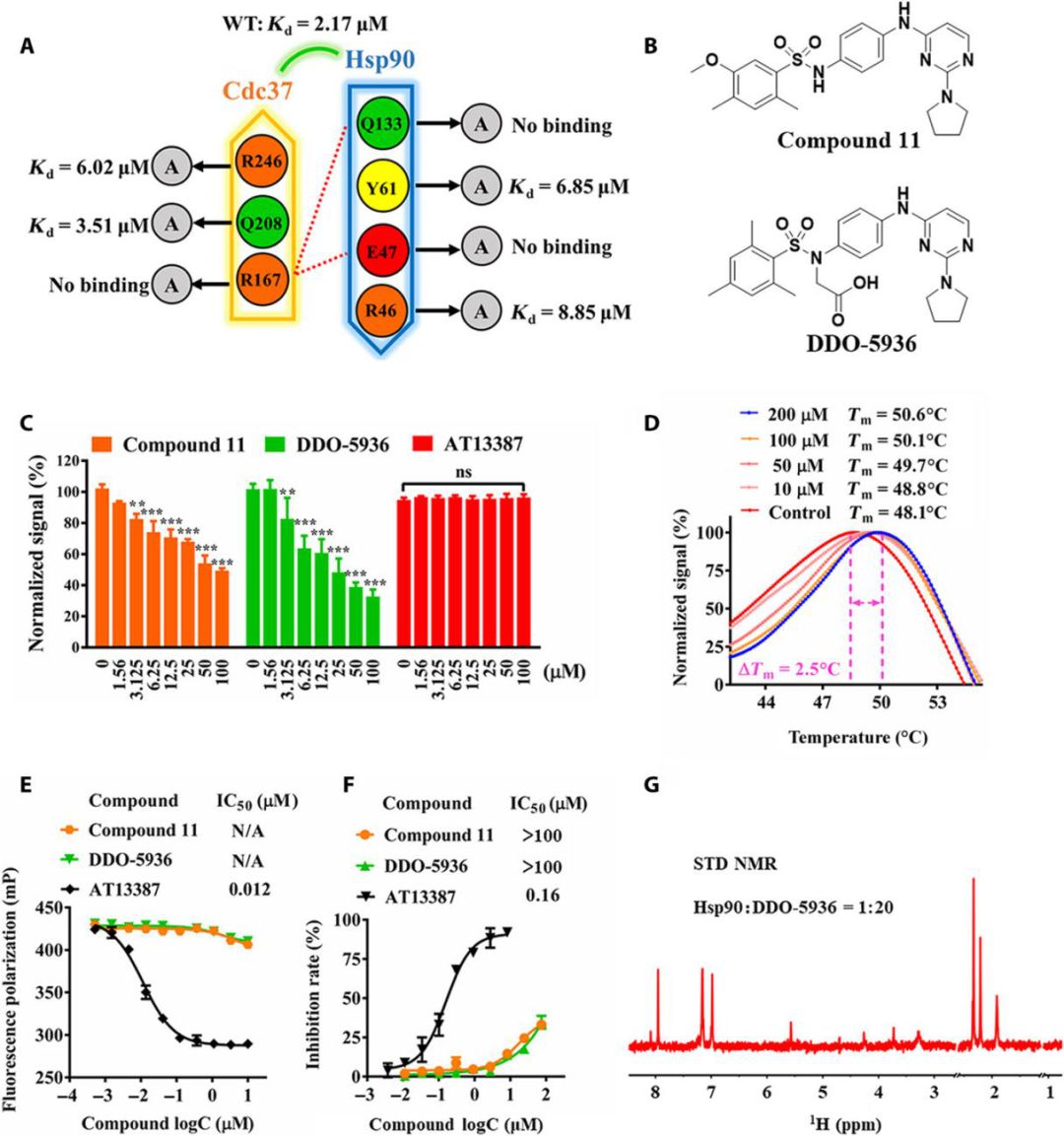
图4.通过筛选得到Ddo-5936抑制剂
图片来自ScienceAdvances
机制研究
细胞内作用机制研究结果表明,DDO-5936阻断Hsp90-Cdc37相互作用后对激酶类蛋白的直接降解影响较小,影响较大的是阻滞其磷酸化的成熟过程,从而达到抗肿瘤细胞增殖的效果。进一步研究发现,DDO-5936具有较高的靶标特异性,显著抑制细胞周期,并在体内药效学研究中表现出了初步的有效性。
总结
绝大多数的蛋白酶需要Cdc37蛋白的协助完成Hsp伴侣循环最终实现成熟与释放,不同于以往与Hsp形成竞争关系的抑制剂,阻断Hsp与Cdc37的相互作用也是一种好的办法,这样不仅可以替换那些有毒副作用的抑制剂药物,也可以很好地阻断癌症的发生,起到治疗疾病的作用,此文章首次通过动力学模拟和结合自由能计算等方法阐明了此过程的机理并为新一代抑制剂的研究提供参考。本工作不仅为调控靶标Hsp90在肿瘤中的药物研发开辟了全新的思路,而且提供了优质的先导化合物,为阻断Hsp90-Cdc37蛋白-蛋白相互作用提供了重要的药理学证据和优质的小分子先导化合物 。
参考文献:
1. Wang L, Li L, Gu K, et al. Targeting Hsp90-Cdc37: A Promising Therapeutic Strategy by Inhibiting Hsp90 Chaperone Function. Current Drug Targets 2017;18:1572-85.
2. Wang L, Li L, Zhou Z H, et al. Structure-based virtual screening and optimization of modulators targeting Hsp90-Cdc37 interaction. Eur J Med Chem 2017;136:63-73.
3. Verba K A, Wang R Y R, Arakawa A, et al. STRUCTURAL BIOLOGY Atomic structure of Hsp90-Cdc37-Cdk4 reveals that Hsp90 traps and stabilizes an unfolded kinase. Science 2016;352:1542-47.