
引言
配体与其分子靶标结合机制的精准描述是开展药物设计的基础。配体-蛋白质结复合物的结合自由能计算对于研究配体的结合模式至关重要。而精确的结合自由能计算方法往往因其较差的用户友好性而受到了一定限制进而妨碍了它们的广泛应用。瑞士提契诺大学的Vittorio Limongelli详细介绍了漏斗-元分子动力学方法的高级应用指南(Funnel-Metadynamics Advanced Protocol, FMAP),作者开发了一个灵活且易于使用的基于用户图形界面(GUI)的用于漏斗-元分子动力学模拟的软件工具,漏斗-元分子动力学方法采用了漏斗形约束势能来研究配体-蛋白质结合模式,并能够准确计算出配体与蛋白质的绝对结合自由能。本FMAP指导使用者完成结合自由能计算过程的所有阶段,从准备输入文件到成品模拟再到最后的结果分析。此外使用该方法除了能够提供配体结合模式和绝对的结合自由能之外,还能给出其它潜在的配体结合模式和水分子的作用,进而提供对配体结合机理的详细描述。
在介绍FMAP之前,我们先简单描述下结合位点以及结合模式和结合机制的定义:
1)结合位点(binding site)是靶标分子与内源性或外源性配体结合的区域;
2)配体结合模式(ligand binding mode)是配体在结合位点的结合构象的表示;
3)结合机理(binding mechanism)是配体进入结合位点的途径。
早在2013年,文章作者就提出了漏斗-元分子动力学(FM),这是一种使用自适应地偏置势来模拟配体从其完全溶剂化状态到最终结合位点的结合过程的结合自由能计算方法。在选定的自由度空间内的高斯函数之和称为集合变量(CV)。这种方法可以研究配体结合模式,并提供精确的蛋白质-配体结合自由能计算。此外,FM还能提供对配体结合机制的动力学过程的解释,包括存在其它潜在的配体结合模式和其他与能量相关的状态(如结合速率限制状态)。FM将元动力学的偏置势与应用于靶标结构的漏斗形约束势相结合,约束势是包括配体结合位点的锥形约束和指向溶剂的圆柱形约束的组合。在FM中,当配体探索漏斗区域内的区域时,系统不会感觉到漏斗势的存在;当配体到达漏斗的边缘时,会向系统施加排斥势,从而使其从漏斗外部的区域中消失。如果适当选择漏斗的形状,则结合位点处的采样不会受到外部偏置势的影响,而在外部水环境中,排斥势会减小探索圆柱区域的空间。如此带来的结果是,通过观察多个结合和未结合事件进而实现加速采样,这些事件导致自由能计算和定量良好表征的结合自由能面(BFES)的快速收敛。通过BFES,可以将配体结合模式确定为最低自由能最小值,并使用以下公式计算绝对的蛋白质-配体结合自由能:
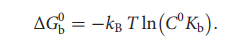
在此,C0是所有反应分子的1 M的标准浓度,可用于与实验进行比较;kB是玻尔兹曼常数;T是系统的温度;kb是结合态和未结合态之间的自由能差中获得的平衡结合常数。结合自由能仅取决于这两个状态的自由能值,而与连接彼此的路径无关。目前,FM已被不同的研究小组成功地用于研究各种配体-蛋白质和配体-DNA结合复合物,确定与晶体学数据相符的结合方式,并准确地预测了实验性结合自由能。表1列出了FM应用于不同体系的情况。
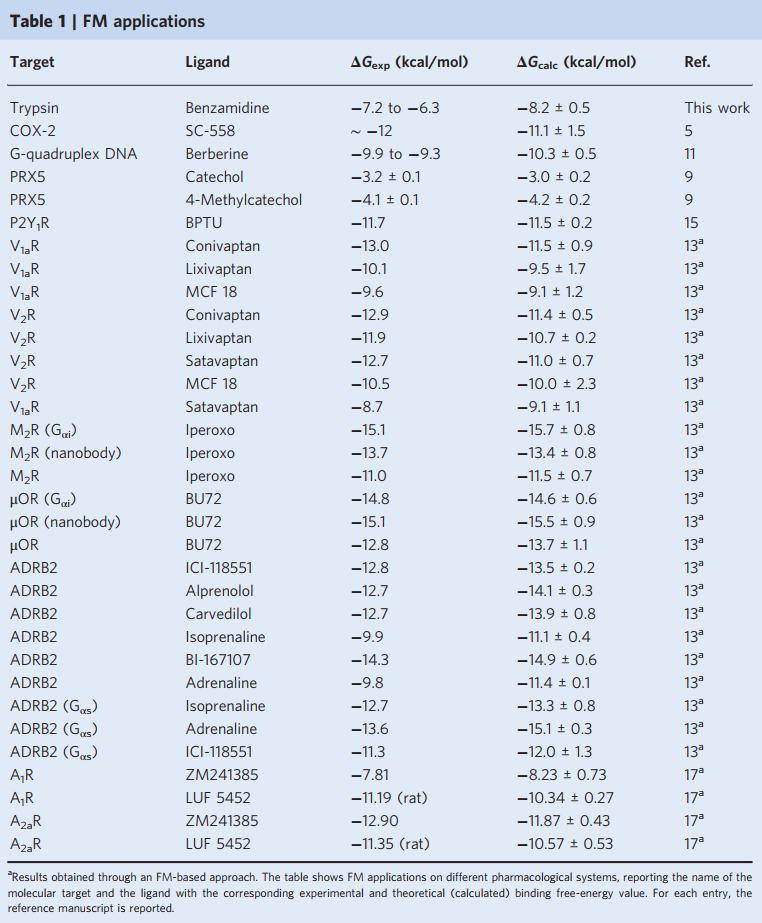
表1 FM的应用情况总结
图片源自Nature Protocols.
作者在程序中提供了设置漏斗形偏置势所需的参数的更详细说明,成功案例研究中使用的FM参数如图1所示。
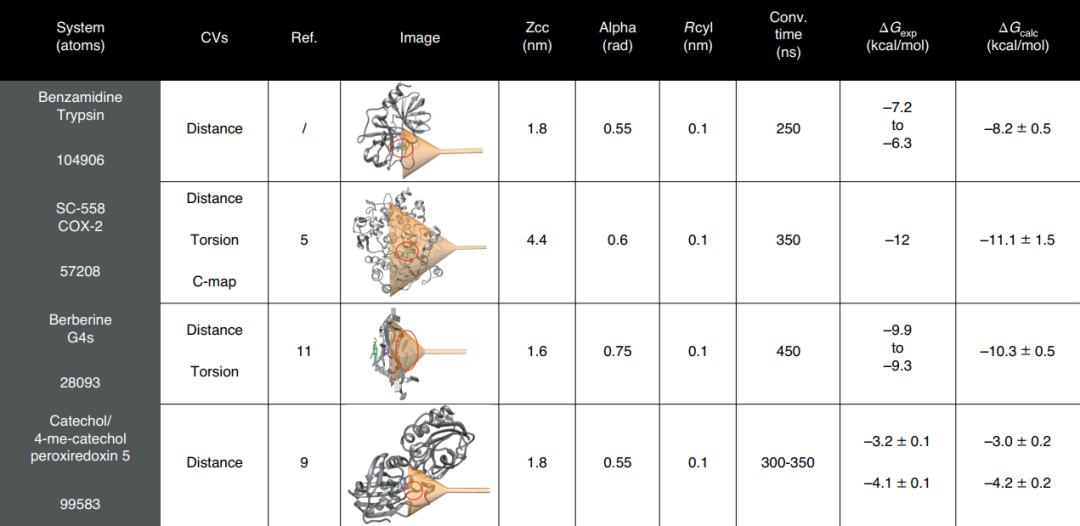
图1 FM参数设置示例
图片源自Nature Protocols.
与目前可用的结合自由能计算手段相比,FM具有以下优点:
1)不需要关于配体结合模式的先验知识。研究者可以随机选择相对于蛋白质结合位点的配体的起始位置,并让配体找到其到达结合位点的途径;
2)所研究的配体之间不需要结构相似性,例如在FEP的情况下;
3) 配体、蛋白质和溶剂分子是明确的,并且在FM中具有完全的柔性。因此,在配体结合过程中可以细致研究和评估水分子和蛋白质的运动。这代表了相对于其他方法的重大改进,因为溶剂化和去溶剂化作用、构象选择和诱导拟合作用通常在正确识别配体结合模式中起决定性作用;
4)整个配体结合过程是可重复的;
5)FM对非收敛结果能够自我诊断。在CV选择不当的情况下,计算不会收敛,并且可以轻松检测到采样问题(例如磁滞现象)。
当然,FM方法也有一定的局限或者难点所在,主要体现在:
1)CV的选择。在FM中,CV的选择是至关重要的一步,因为错误的CV选择会导致结果无法收敛。CV必须描述配体结合过程中系统的最慢自由度,从而能够区分模拟过程中访问到的系统的不同状态;
2)维度问题。FMAP十分灵活,可以适应使用任何类型的CV。但是,CV的数量应尽可能少,因为重建自由能的计算成本随CV的数量呈指数增长;
3)自由能收敛问题。在错误的CV选择或忽略重要的慢自由度的情况下,自由能计算就不会收敛;
4)准确度。FM已被证明能够以小于1.5 kcal mol的精度预测实验结合自由能。但是,应该考虑到FM是基于MD模拟的。因此,计算结果取决于蛋白质和配体所用力场参数的准确性以及系统的设置(例如氨基酸-配体质子化状态);
5)计算成本。FM模拟代码的最新版本和计算能力的指数级增长使得如今有可能在合理的时间内在本地计算机和高性能计算集群(HPC)上执行计算。值得一提的是在原文中,作者特别针对CV的选择和FM计算收敛检查给了详细的建议和步骤描述,本文由于篇幅所限,不在此一一列出。
FMAP利用GUI进行交互以准备输入文件,以进行FM模拟和结果分析。GUI通过以下三个阶段组成的分步过程来帮助研究者进行快速地上手使用:
1)预处理阶段。在靶标蛋白上设置漏斗形偏置势;定义FM参数并准备用于FM模拟的输入文件(通过GUI建议标准值并显示帮助消息);
2)模拟阶段。用户使用其首选的MD模拟软件(包括Gromacs、Amber和NAMD)启动FM,同时提供了命令和故障排除信息的列表;
3)后处理阶段。FM结果和数据检索工具的分析。
FMAP GUI(https://github.com/limresgrp/FMAP_v1/tree/master/funnel_gui)以VMD程序插件形式体现,模拟代码在PLUMED-v.2(https://www.plumed.org/doc-master/user-doc/html/_installation.html)中实现。图2和图3展示了FMAP GUI在预处理阶段和后处理阶段的软件设置界面。注:原文对软件每个设置选项以及使用过程中可能遇到的问题都进行了详细的描述和给出了合理的建议,具体请参看原文。

图2 FMAP GUI预处理界面(Funnel.tcl)
图片源自Nature Protocols.
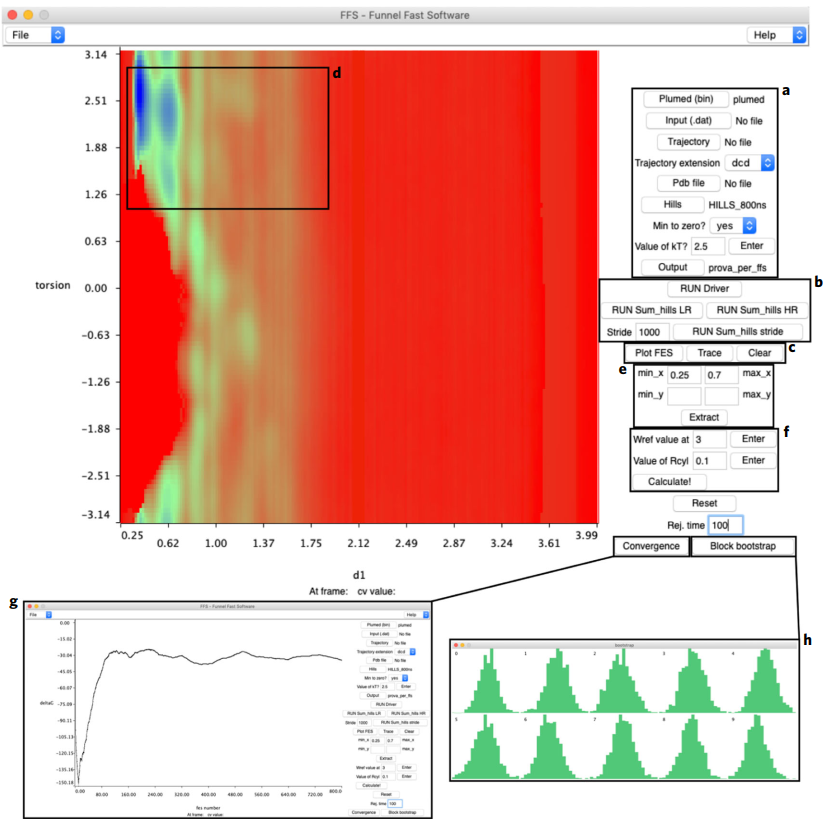
图3 FMAP GUI后处理界面(FFS.tcl)
图片源自Nature Protocols.
最后,作者将FAMP应用到了苯甲酰胺-胰蛋白酶体系(图4),通过该方案计算得出的胰蛋白酶-苯甲酰胺的绝对结合自由能为−8.2±0.5 kcal/mol,与先前的实验工作中报道的几乎完全一致,并且苯甲酰胺结合模式的三维结构与X射线晶体学揭示的结构十分接近(图5),显示了FAMP方法强大的可靠性和计算准确性。
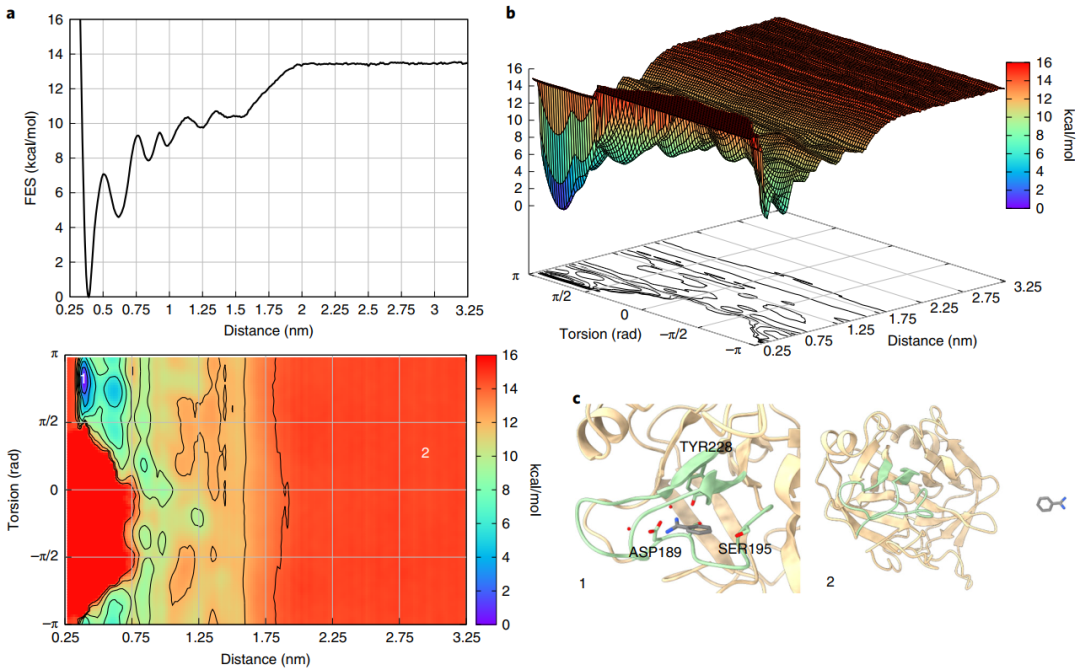
图4 苯甲酰胺-胰蛋白酶体系的BFES
图片源自Nature Protocols.
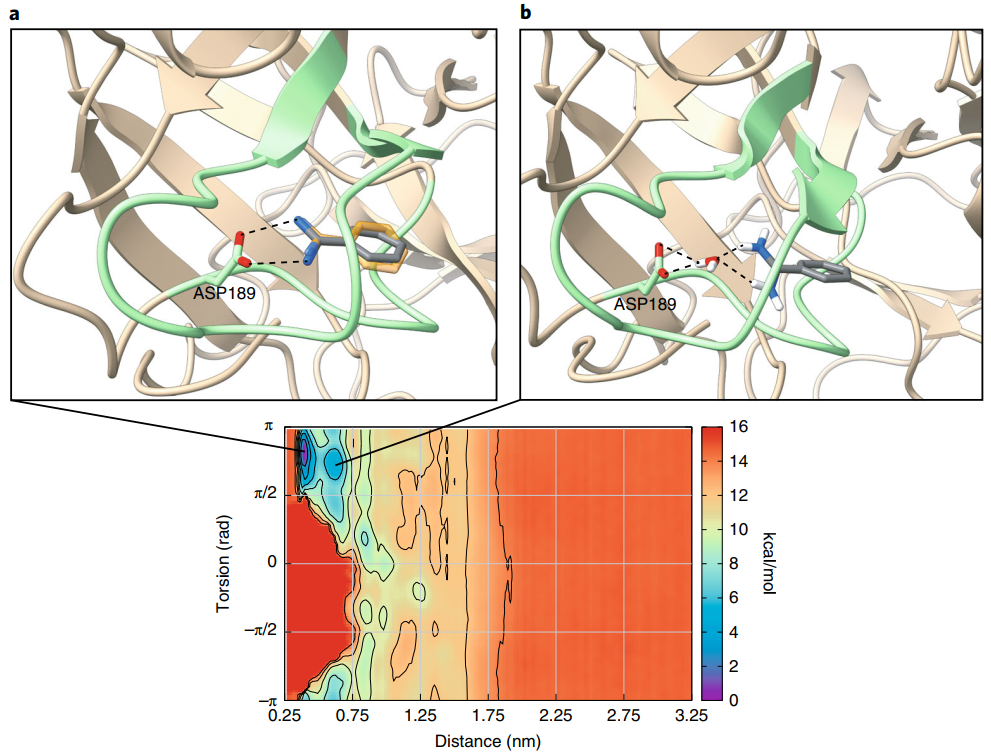
图5 苯甲酰胺结合模式的FAMP计算结果(灰色)与晶体结构(橙色,PDB:4i8g)的比较
图片源自Nature Protocols.
参考文献
Ligand binding free-energy calculations with funnel metadynamics. Stefano Raniolo,Vittorio Limongelli. Nature Protocols. 2020:2837–2866. DOI: 10.1038/s41596-020-0342-4
Funnel metadynamics as accurate binding free-energy method. Limongelli, V. et al. Proc. Natl Acad. Sci. USA 110, 6358–6363 (2013): DOI: 10.1073/pnas.1303186110