引言
细胞色素氧化酶是一种氧化还原偶联的质子泵,具有重要的生物学功能。作者通过研究质子化和水动力学,以及通道入口的构象动力学,结合实验和计算方法,解析了质子通道活化的机理。

先睹为快
单位与作者
柏林大学物理系Ulrike Alexiev教授,
柏林大学化学与生物化学研究所Ernst Walter Knapp教授
蛋白靶点
细胞色素氧化酶(CcO)
计算方法
同源模建,分子动力学模拟,量化计算
计算软件
VMD,NAMD,Jaguar v.7.7
计算流程
使用VMD将CcO放置在模拟脂质双层中,并嵌入TIP3P21水盒子中,模建出CcO蛋白膜复合物;使用量子化学程序Jaguar v.7.7,用B3LYP方法和6-31g**基组计算荧光素的电荷;使用NAMD对CcO的还原状态(R)和氧化状态(O)进行了47ns的MD模拟,对最后30ns进行分析。
细胞色素氧化酶(cytochromec oxidase,CcO)是一种氧化还原偶联的质子泵,催化分子氧还原为水,从而建立起促进ATP合成的跨膜质子梯度。CcO(图1)使用两个质子吸收通道,D和K通道。与D通道相比,K通道不构成质子传导氢键的连续通道,只在还原相中起作用,使其质子输运机制变得神秘。理论研究表明,K通道内的选择性水化变化被激活,对质子的矢量传输至关重要。作者通过研究质子化和水动力学,以及通道入口的构象动力学,结合实验和计算方法,剖析了质子通道活化的机理。
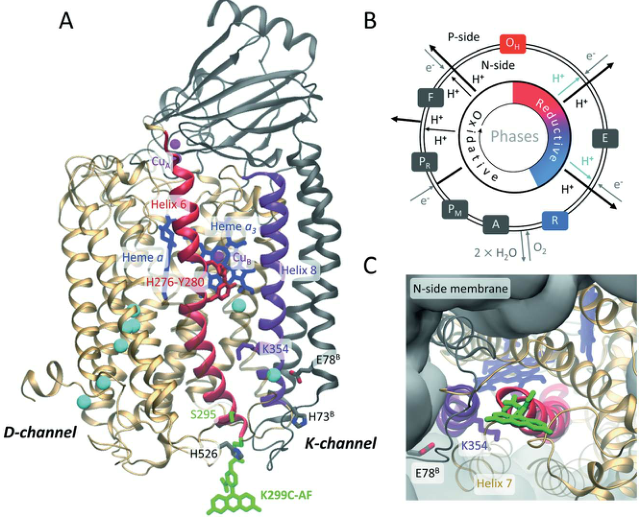
图1. CcO的结构和催化循环示意图
图片来源Chem. Sci.
通过时间分辨荧光去极化实验和分子动力学(MD)模拟证明,双核中心的静电变化导致长程构象变化向K通道入口传播。实验和模拟的局部探针pKa位移分析表明(图2),这些氧化还原诱导的长程结构重排影响了K通道蛋白表面的氢键网络。同时,偶极弛豫研究表明,K通道入口处的选择性水合作用与通道开放有关。这些单个氧化还原引发的因果关系变化的复杂相互作用,定义了K通道瞬态质子传导的机制。理论研究发现,Y280在催化转化过程中会根据质子化状态发生构象变化。这种构象变化可能沿着螺旋6以侧链构象和复杂的氢键重排的形式向蛋白质表面移动,以增加通道入口处的构象动力学。
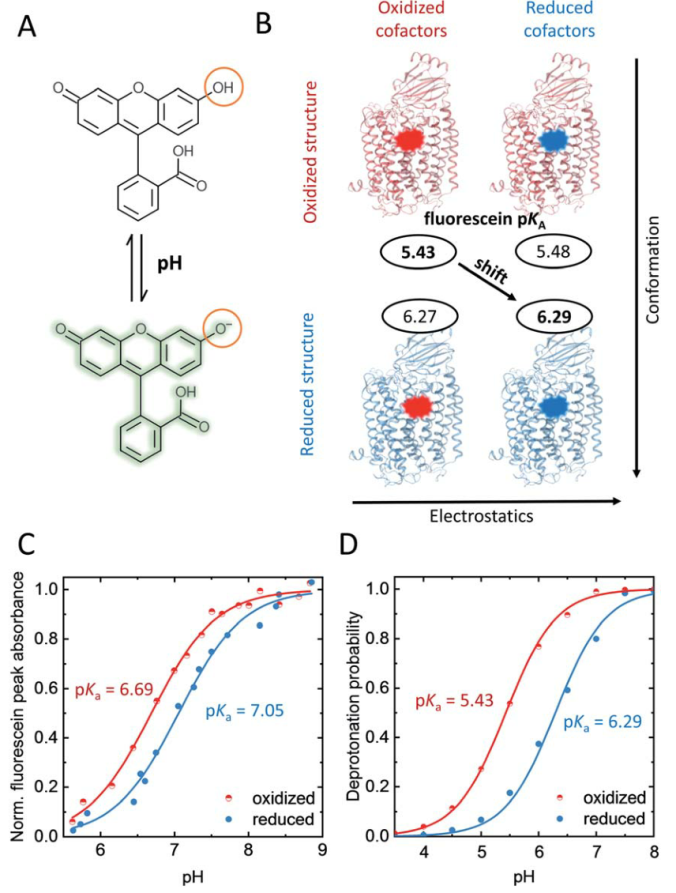
图2. K通道入口处氧化还原依赖的质子化变化
图片来源Chem. Sci.
在研究中确实观察到了构象动力学的变化(图3),并与K通道下部局部水化动力学的变化相关。可以合理地假设,这种水合作用的增加与理论研究中观察到的K354侧链的K通道的拓宽和构象转换有关。因此,在D和K通道之间建立从通道上部到双核中心的连接和切换活动而提议的开关,似乎与K通道的下部紧密耦合。观察到的通道入口周围的水可及性增加(图4)为活动通道上部的建议水化增加提供了缺失的环节。还原酶通道N侧表面较低的刚性对质子吸收是有利的,以前的相关光谱实验支持这一点,表明单电子注入后,质子快速瞬时吸收到K通道。
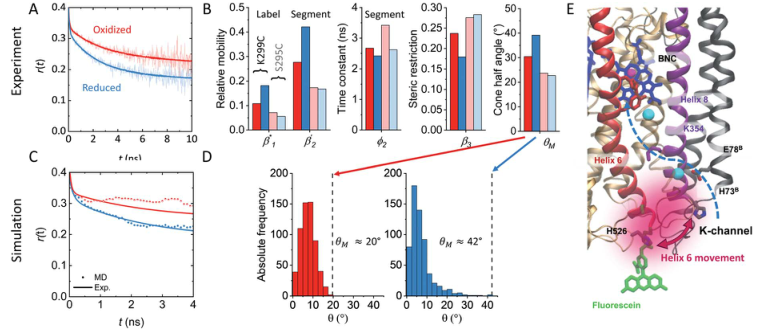
图3. K通道入口氧化还原相关的结构变化
图片来源Chem. Sci.
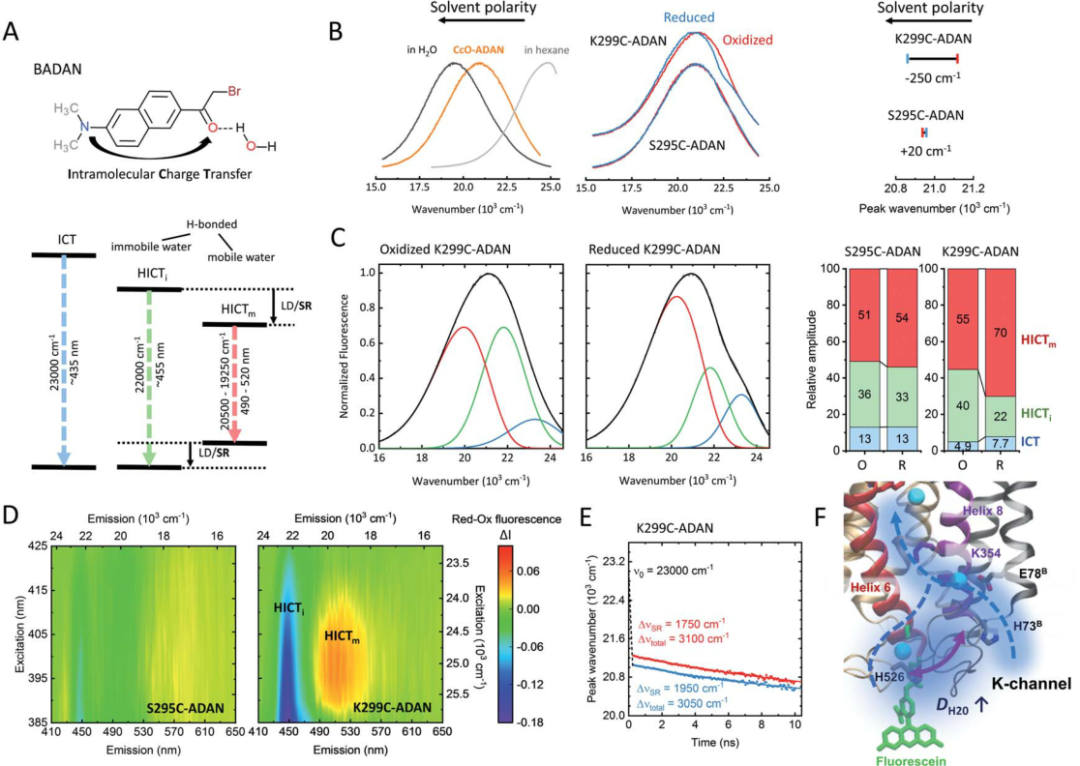
图4. K通道入口附近氧化还原依赖的水动力学
图片来源Chem. Sci.
综上所述,作者认为CcO的氧化还原中心和K通道表面构成了一个长程相互作用网络,通过双核中心在氧化状态下的电化作用触发了稳定的质子“按需”供应。长远来看,这些结果可以促进大家对膜蛋白将离子转移到嵌入的辅因子和跨膜机制的理解。
参考文献
Alexander Wolf.et al.The redox-coupled proton-channel opening in cytochrome c oxidase. Chem. Sci., 2020. DOI: 10.1039/c9sc06463j