
先睹为快
作者
中国科学院上海有机化学研究所刘文教授
美国加州大学洛杉矶分校的K. N. Houk教授
研究对象
D-A环加成酶:PyrI4
计算方法
量子力学计算(Quantum Mechanical Calculations)
分子对接(Docking Calculations)
分子动力学模拟(Molecular Dynamics Simulations)
结合能计算(MM/GBSA Calculations)
量子-分子力学组合计算(QM/MM MD calculations)
计算软件
XTB程序,Gaussian 09,Autodock Vina,Amber 16
计算流程
作者首先通过DFT计算了非酶参与的不同底物质子化状态D-A反应,发现了PyrI4的酸催化效应,并通过前线轨道理论揭示其本质是降低了反应的能级差;接着,作者通过docking,MD模拟,QM/MM模拟研究了PyrI4与不同的底物状态结合,发现了关键的Q115−H117−Y85氢键三联体;此外,作者通过反应内禀性计算和MD模拟探究PyrI4的立体选择性问题;最后作者对PyrI4蛋白N端的α-螺旋结构也进行了研究,揭示了这独特的“盖状”结构对D-A反应过渡态的稳定作用。
引言
狄尔斯-阿尔德反应(D-A reaction,简称“D-A反应”)是一类能够直接形成C-C键的重要有机反应,可以高效地实现对杂环、手性螺环和桥环等复杂结构的构建,也被广泛应用在天然产物和药物分子的合成中。吡咯吲哚霉素(pyrroindomycin,PYR)的生物合成途径中涉及两个D-A环加成酶PyrE3和PyrI4(图1)。这两个酶的晶体结构也已被报道,其中,PyrI4蛋白独特的“盖状”特征。本文作者通过一系列计算的手段研究了PyrI4催化分子内D-A反应的活化效应和立体选择性机理。研究发现,PyrI4的关键活化效应主要来自酸催化、构象诱导自适应机制,即由底物诱导PyrI4的N端“盖状”结构以稳定D-A反应的过渡态构象,产物的立体选择性合成来源于PyrI4酶增强了底物内在的D-A立体选择性。
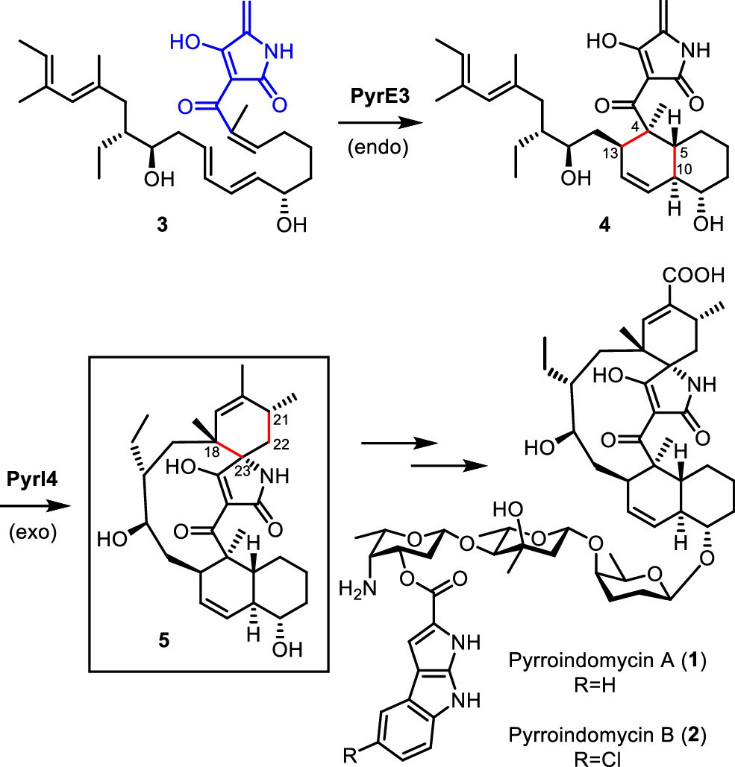
图1. Pyrroindomycin生物合成生物途径中涉及的D-A环加成酶
图片来源于:JACS
研究内容——非酶参与的D-A反应的DFT研究
PyrI4催化合成吡咯吲哚霉素分子中关键的的螺环结构,参与图1中的化合物4到5的过程。作者首先研究了非酶环境下不同PH值对D-A反应的影响,如图2所示,在气相中,4a通过exo过渡态TS1a生成5a的反应能垒高达42.2kcal/mol,将要形成的C-C键分别为1.8和 3.0Å,这说明该环化反应高度异步(highly asynchronous),表明在过渡态形成的部分电荷可能会被极性环境所稳定。特别是,乙醚溶剂化模型(类似于酶疏水内部介电环境)将能垒降低至41.5 kcal/mol,而更为极性的水溶剂化模型将能垒进一步降低至40.0 kcal/mol。然而,目前能垒仍然太高,无法在室温下自发反应。
PyrI4酶的第一个潜在催化作用是对tetramate的质子化。PyrI4-产物的复合物晶体结构显示,活性空腔中富含酸性氨基酸,并且产物的tetramate结构朝向酸性空腔。作者假设PyrI4酶可以质子化内酰胺,通过酸催化加速D-A反应。作者计算了质子化后的4b通过TS1b形成5b的D-A反应能垒为28.8kcal/mol,与非催化反应相比,这种酸催化的D-A反应可显著降低反应能垒。
为了解释为什么PyrI4酶可以通过改变反应的电子性质,使反应势垒降低12.7kcal/mol。作者进行了前线轨道计算(图3),与4a相比,4b的HOMO−LUMO间隙较低,(4.6 vs 7.0 ev),因此非催化的D-A反应是一个逆电子需求的反应,而酸催化的D-A反应是一个顺电子需求的反应。
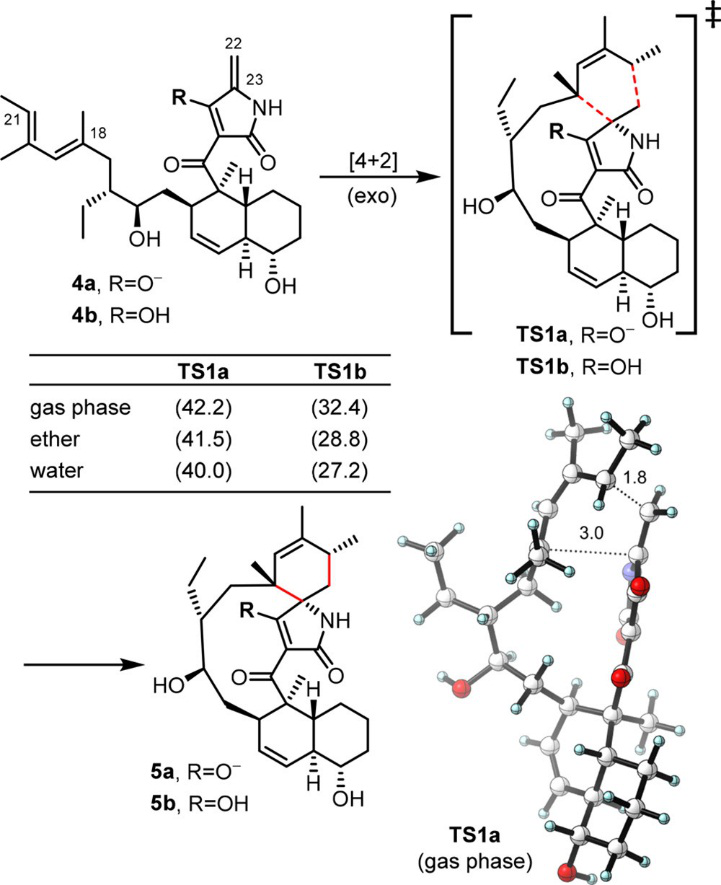
图2. 非酶参与的D-A反应的DFT研究
图片来源于:JACS
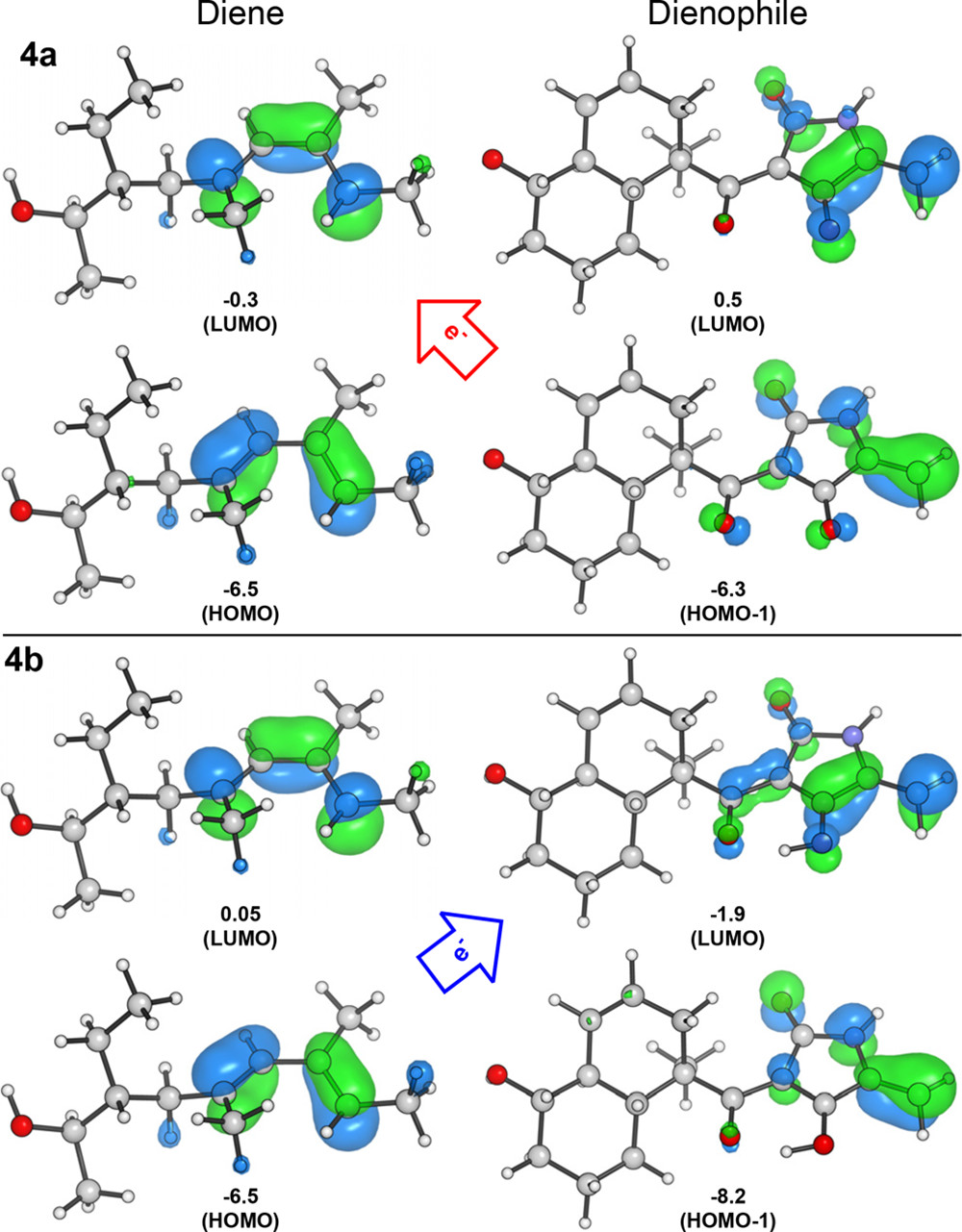
图3. 不同质子化状态下二烯烃和亲二烯烃的轨道分析
图片来源于:JACS
研究内容——PyrI4酶中关键相互作用的计算研究
PyrI4酶的第二个催化作用是与底物的相对高能反应构象结合。图4展示了PyrI4酶和产物的共晶结构,底物和口袋非常紧密的契合在一起,并且口袋中极性和非极性残基分布在产物的对立面,极性tetramate部分被亲水性残基(即E65、Y85、E87、Q115和H117)包围,而非极性十氢萘环与疏水残基相互作用。作者猜测蛋白口袋中亲水和疏水相互作用的协调作用,导致底物先以一种合理的高能反应构象与蛋白结合,然后诱导小分子形成类似D-A反应过渡态的构象。因此,作者提出了一种激活机制,PyrI4只与处于反应性构象(近似过渡态)底物结合。在没有酶的情况下,这种强制构象变化需要6.8kcal/mol能量(图5),为了使这一过程自发进行,PyrI4酶必须使反应构象比驰豫构象稳定至少6.8kcal/mol。
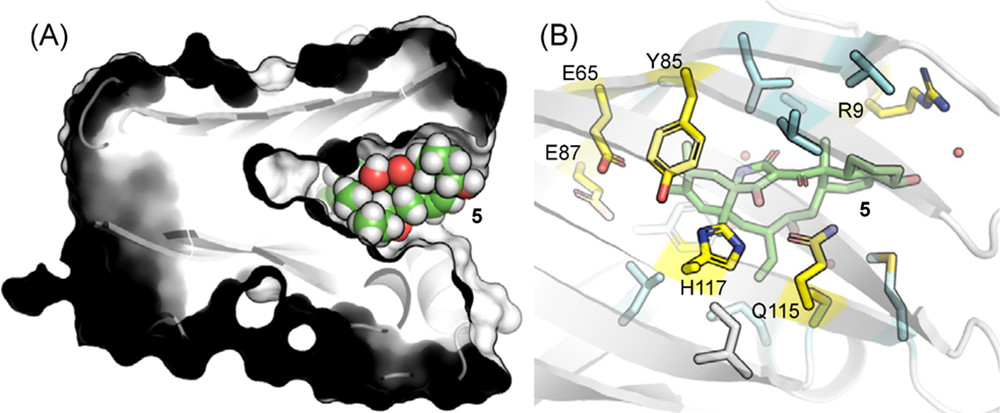
图4. PyrI4酶和产物的共晶结构及相互作用示意图
图片来源于:JACS
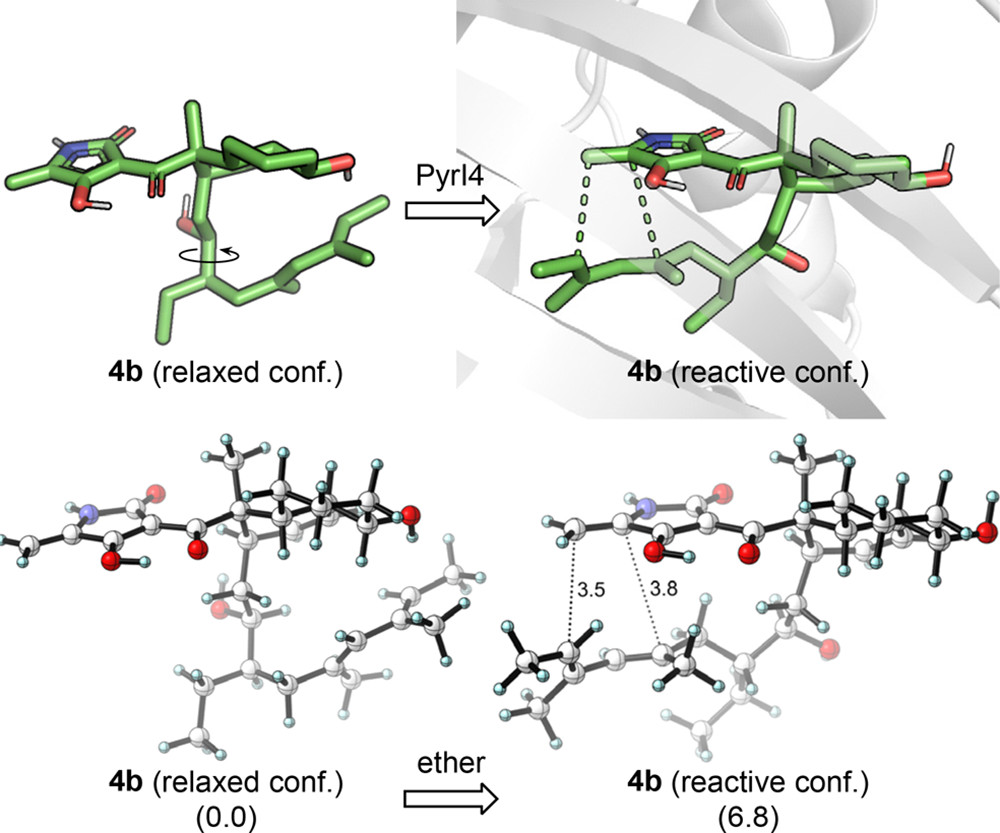
图5. 底物构象变化的研究
图片来源于:JACS
分子对接研究表明,4b的反应构象的对接模式与共晶体结构中的产物相似,但4b的驰豫构象不能结合到口袋(图6)。为了进一步研究不同底物状态与蛋白的结合力,作者用AMBER16进行了分子动力学(MD)模拟,然后应用MM/GBSA方法估算了4-RC、4-TS和4-P的结合能(−48.4、−49.2、−47.2 kcal/mo),结果表明PyrI4选择性地稳定过渡态。
作者发现PyrI4酶的活性中心存在一个氢键三联体,可以稳定TS1b过渡状态。基于先前对接和MD研究,如图7所示,作者构建了一个TS1b−PyrI4复合物理论酶模型(TS1b-T),包含Y85、H117和Q115形成的氢键三联体,由于这三个残基的存在,TS1b-T过渡态(18.7kcal/mol)的自由能比未催化的TS1b(22.0kcal/mol)低3.3kcal/mol。如果只把Q115残基划入,过渡态的能量则为21.1 kcal/mol,相差的2.4 kcal/mol来自Y85−H117−Q115氢键三联体的协同效应。H117与Q115之间的氢键增加了Q115的酸性,使其成为更强的氢键供体。
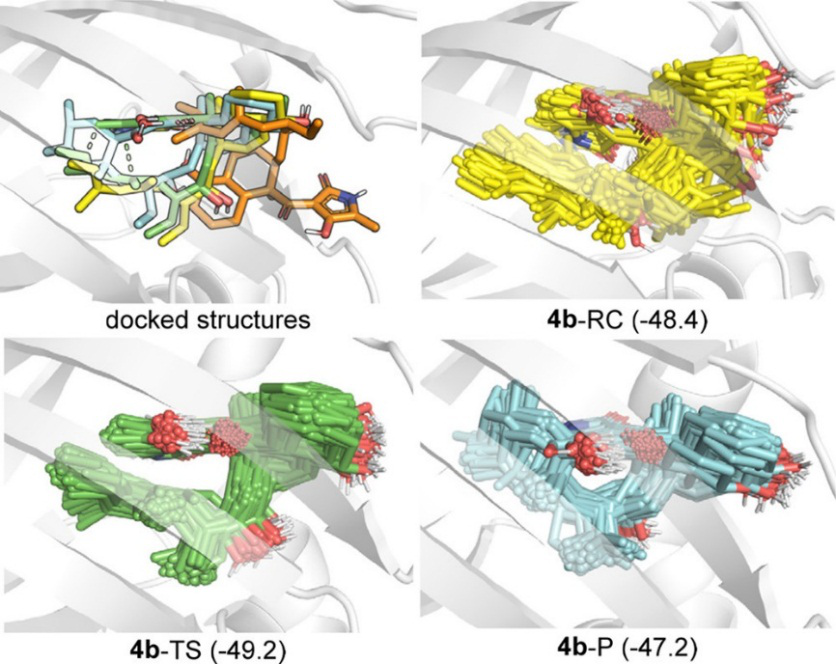
图6. 不同底物状态与蛋白结合的研究
图片来源于:JACS
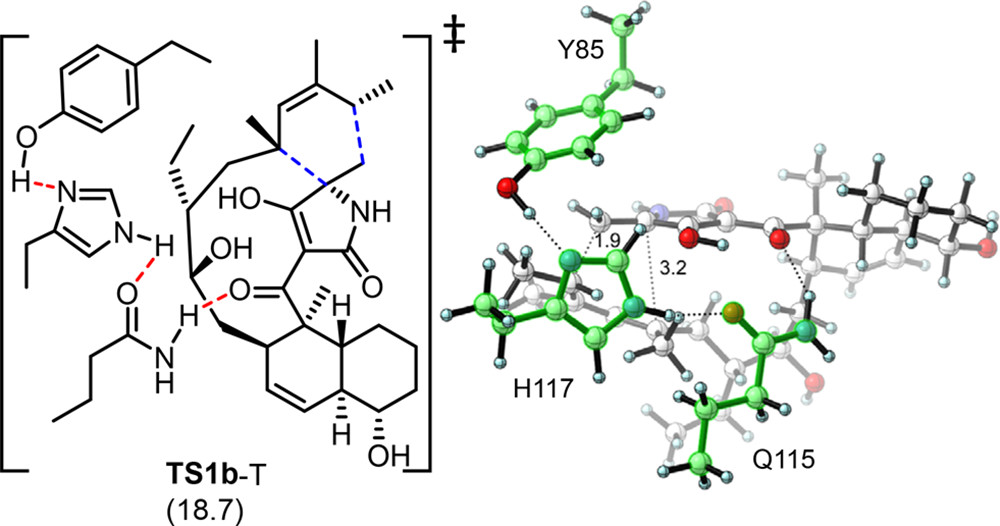
图7. TS1b−PyrI4复合物理论酶模型
图片来源于:JACS
然而,为了降低D−A反应势垒,PyrI4酶必须选择性稳定过渡态,作者假设Y85−H117−Q115氢键三联体,只有在酶促反应进入过渡状态时才能组装起来。为了验证这个假设,作者应用MD模拟了PyrI4分别结合反应物、过渡态和产物时,这一关键氢键三联体的动力学行为。结果如图8所示,只有当与过渡态结合时,氢键三联体才能形成稳定的氢键网络(4b-TS)。通过进一步残基能量分解表明,其他残基对反应势垒的贡献为0.7 kcal/mol。综上所述,Q115−H117−Y85氢键三联体将能垒降低3.3 kcal/mol,其他PyrI4残基共同降低能垒0.7 kcal/mol。最终计算的反应自由能垒约为18 kcal/mol,与实验kcat换算的16.7 kcal/mol一致。
综上所述,PyrI4激活其底物进行D−A反应主要通过:(1)PyrI4质子化底物的tetramate部分,使自由能垒降低12.7 kcal/mol;(2)底物以反应构象与PyrI4结合,使自由能垒降低6.8 kcal/mol;(3)Q115−H117−Y85氢键三联体选择性稳定过渡状态,使自由能垒降低了3.3 kcal/mol;(4)其他残基的贡献加合将能垒降低了0.7 kcal/mol。总的来说,PyrI4酶一共使D−A反应的能垒降低约24 kcal/mol,使该反应能在室温下快速发生。
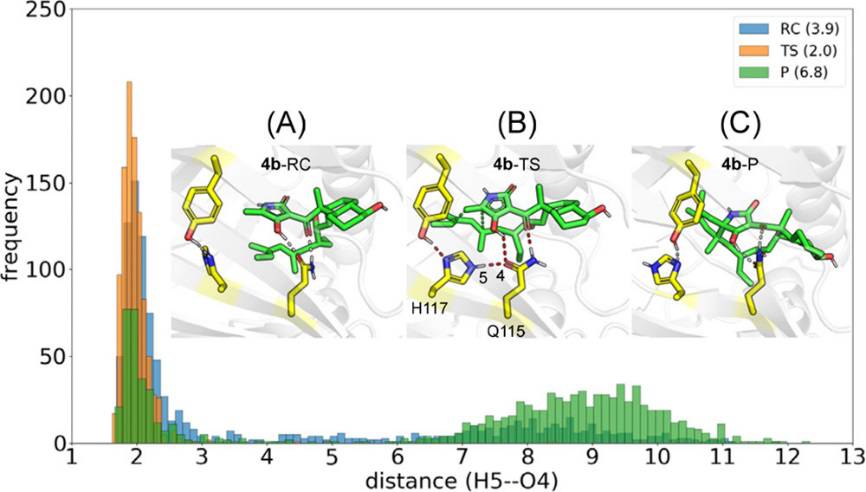
图8. Y85−H117−Q115氢键三联体的MD模拟
图片来源于:JACS
研究内容——PyrI4酶中立体选择性问题的计算研究
随着PyrI4酶对底物激活作用的确立,作者对PyrI4酶如何控制D−A反应的立体选择性问题进行了研究。原则上,化合物4的D−A反应可以得到四种可能的产物。作者首先研究了这个反应的固有选择性(图9),结果显示,exo产物过渡态(TS1b)比endo产物过渡态在能量上低,反应会倾向形成TS1b。为了研究PyrI4对D−A反应立体选择性的影响,作者将四种可能的过渡态分别对接到PyrI4的活性中心。TS1b和TS4b都能与键残基Q115形成氢键,但只有过渡态TS1b与产物结构有显著重叠。虽然四种过渡态的结合能预测值相似,但TS1b显示出最大的结合自由能(−12.6kcal/mol)。作者分别对四个过渡态的复合物进行了500 ns MD模拟,通过追踪关键的键长变化,发现只有TS1b可以保持反应构象,相比之下,其他立体异构体已经驰豫为非反应构象。这些结果表明PyrI4的活性口袋已经演化成选择性地结合底物构象,从而得到了目标产物5。
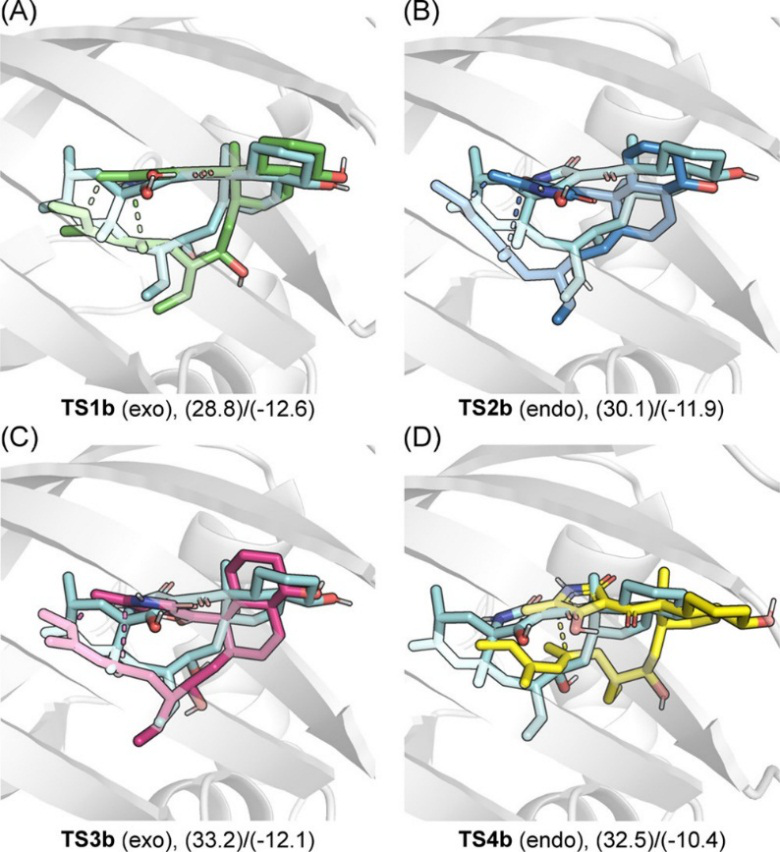
图9. PyrI4对四个立体异构过渡态的选择性
图片来源于:JACS
研究内容——特殊的α-螺旋结构(α0)的角色研究
在阐明了PyrI4的活化机理和立体选择性的基础上,作者进一步研究了lid在PyrI4的催化机理中的作用。PyrI4中有一个独特结构特征即催化空腔顶部存在一个短的N-端α-螺旋(α0),称为lid。先前的实验突变表明,α0对PyrI4的活性至关重要,核磁共振研究表明其是高度动态的。作者先前假设α0可以捕获柔性底物,从而促进底物结合。为了研究了底物存在与否对α0的构象变化影响,通过DSSP分析了MD模拟中α0的二级结构变化。作者首先研究了野生型PyrI4(WT)在高温下的热稳定性(图10)。在apo-PyrI4(不包含底物)在373k下的1μs MD模拟中,α0分解成一个无规则的线圈(图10C)。在373 K温度下的模拟时间内,α0的螺旋结构占比56%(图8A),而在室温下,该占比为82%,这与实验观察结果一致,即在反应前将酶在100℃下加热20分钟可导致酶活性降低约50%。接下来,作者研究了底物结合后对α0的影响,当PyrI4与天然底物的反应构象结合时,α0的螺旋结构的统计含量较高(92%),并且过渡态结合时达到最大值(94%)。相比之下,apo-PyrI4(WT-apo)的α0在相同的模拟条件下显示出较少的(82%)螺旋结构。这些结果表明,当α0与反应构象的底物、过渡态结合时,其热力学稳定性较高。
为了解释为什么α0与底物结合时会更稳定,作者着重研究了位于α0起始位置的精氨酸(R9)。单点突变实验表明,突变株R9A的催化不活跃。对apo-R9A的MD模拟表明,与野生型(82%)相比,R9A的α0具有相似的螺旋含量(79%)。然而,与野生型相比(94%),R9A-TS复合物的α0-螺旋含量较低(78%),表明底物不能像野生型那样稳定R9A突变体的α0结构,因此,TS与R9A突变体的结合力不如WT,结合自由能计算结果也证明了这点。进一步研究了R9在催化反应中的作用,从各种MD模拟结果分析,作者发现在WT-TS复合物中R9与D74形成盐桥相互作用(图11),这种盐桥作用只有在TS与WT-PyrI4结合时才稳定。在WT-apo模拟中,R9以随机取向存在,并且大部分时间与水溶剂分子相互作用。相反,当底物与PyrI4结合时,R9不仅与D74形成盐桥作用,而且与底物的O2形成氢键(图11A、B)。因此,底物诱导R9,D74之间形成稳定的氢键网络,从而稳定α0。并且过渡态与α0相互作用最为强烈,在WT-TS复合物的分子动力学模拟中,R9和D74的平均接触距离为3.0Å,在反应物和产物中,R9-D74平均接触距离分别为3.6和3.5Å。这些结果也表明PyrI4和过渡态结合时,存在诱导契合/构象选择机制。
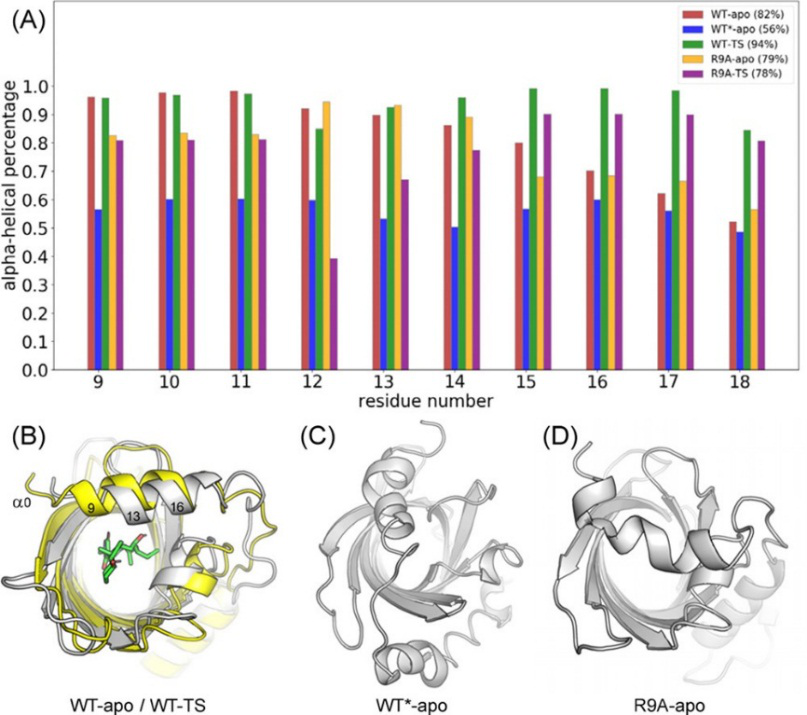
图10. 野生型PyrI4在高温下的热稳定性研究
图片来源于:JACS
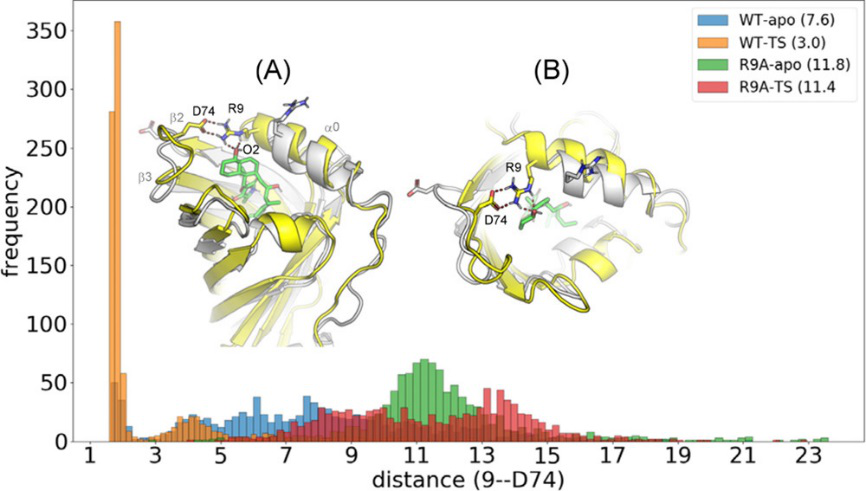
图11. R9与D74的盐桥相互作用研究
图片来源于:JACS
综上所述,作者详细阐明了PyrI4催化D−A反应的催化机制。PyrI4对底物的活化效应主要来源于酸催化和Q115−H117−Y85氢键三联体,并且选择性催化四种过渡态中的TS1b,底物诱导PyrI4的N端“盖状”结构可以稳定D-A反应的过渡态构象。
参考文献
Yike Zou, et al. Computational Investigation of the Mechanism of Diels−Alderase PyrI4. J. Am. Chem. Soc. 2020, 142, 47, 20232−20239. DOI: 10.1021/jacs.0c10813.